(2)CH4中共用电子对偏向C、SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为________。
共用电子对偏向一方的共价键是极性共价键
共价键是由两个或多个电负性相差不大的原子间通过共用电子对而形成的化学键。
A、对
B、错
下列分子中有两对共用电子对的是
下列分子中有两对共用电子对的是
A、C12B、NH3C、H2OD、CaCl2下列分子中有两对共用电子对的是( ).
A、Cl2
B、NH3
C、H2O
D、CaCl2
两个或多个电负性相差不大的原子间通过共用电子对而形成的化学键叫做()。
A、离子键
B、氢键
C、共价键
D、金属键
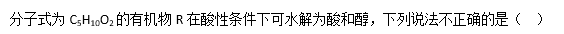
A这些醇和酸重新组合可形成的酯共有40种
B分子式与R相同的酸与足量碱石灰共热,最多可得到2种烷烃
CR水解得到的酸至少有5对共用电子对数目
DR水解得到的醇发生消去反应,可得到4种烯烃
有关酰胺的说法错误的是
A.酰胺一般是碱性的化合物
B.酰胺氨基氮上的未共用电子对与羰基的π电子形成共轭体系
C.酰胺C—N键出现一定程度的双键性
D.酰胺碱性比氨气弱得多
E.酰胺在碱性条件下水解可生成酸盐
就生物碱分子中N原子未共用电子对杂化方式而论,其碱性顺序为
A.sp3>sp2>sp
B.sp>sp2>sp3
C.sp2>sp>sp3
D.sp2>sp3>sp
E.sp3>sp>sp2
关于头孢菌素的结构特点的说法,错误的是()
A、基本结构是7-氨基头孢烷酸
B、是由β-内酰胺环与氢化噻唑环并合而成的
C、其β-内酰胺环分子内张力较小
D、氢化噻嗪环中的双键与β-内酰胺环中氮原子的未共用电子对形成共轭
E、结构比青霉素稳定
就生物碱分子中N原子未共用电子对杂化方式而论,其碱性顺序为()
A、sp3>sp2>sp
B、sp>sp2>sp3
C、sp2>sp>sp3
D、sp2>sp3>sp
E、Sp3>sp>sp2
1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是()
A、N5+共有34个核外电子
B、N5+中氮氮原子间以共用电子对结合
C、化合物N5AsF6中As化合价为+1
D、化合物N5AsF6中F化合价为-1
AN5+共有34个核外电子
BN5+中氮--氮原子间以共用电子对结合
C化合物N5AsF6中As的化合价为+1
D化合物N5AsF6中F的化合价为-1
A、这些醇和酸重新组合可形成的酯共有40种
B、分子式与R相同的酸与足量碱石灰共热,最多可得到2种烷烃
C、R水解得到的酸至少有5对共用电子对数目
D、R水解得到的醇发生消去反应,可得到4种烯烃